Heisenberg Belirsizlik İlkesi
Karl Werner Heisenberg’in 1927’de ortaya attığı Belirsizlik İlkesi, fiziksel anlamda bir parçacığın bazı farklı özelliklerinin aynı anda sonsuz hassaslıkla ölçülemeyeceğini belirten bir ilkedir. Bu yazımızda Heisenberg Belirsizlik İlkesi’ni tarihçesi ve mantığı ve örnekleriyle inceledik.
13.01.2015 tarihli yazı 70669 kez okunmuştur.
1927 yılında Alman fizikçi Karl Werner Heisenberg tarafından ortaya atılan Heisenberg Belirsizlik ilkesi kuantum mekaniğinin en büyük ve önemli yaklaşımlarından biridir. Özüne inildiğinde doğadaki en temel olguların ve niceliklerin belirsizliğini anlatan Belirsizlik ilkesi, ayrıca klasik fizik ile kuantum mekaniğinin birbirinden ayrıldığı noktadır. Genel hatlarıyla bakıldığında belirsizlik ilkesi (konum ve momentum için) fiziksel bir sistemde konum ve momentumun aynı anda kesin olarak belirlenemeyeceğini, daha doğrusu bu niceliklerin sadece bazı karakteristik belirsizliklerle bulunabileceğini söyler.

►İlginizi Çekebilir: Schrödinger Denklemi Nedir? | Kuantum Dersleri
Belirsizlik kavramı, fiziksel literatürde birkaç farklı anlama sahiptir. Bu kavram bilgi eksikliği, deneysel sapma veya nicelikteki anlam bulanıklığını belirtebilir. Belirsizlik teorisini ilk olarak 1927 yılında "Ueber den anschaulichen Inhalt der quantentheoretischen Kinematik und Mechanik" isimli makalesinde (kuantum teorisi kinematik ve mekanik üzerine bir makale) açıklayan Heisenberg için fiziksel literatürde kesinlik ve netlik neden bir problem olarak görünüyordu?


Δx: Konumdaki belirsizlik, Δp: momentumdaki belirsizlik
ΔE: Enerjideki belirsizlik, Δt: zamandaki belirsizlik
ΔE: Enerjideki belirsizlik, Δt: zamandaki belirsizlik
Heisenberg’e göre bir parçacığın konumu ve momentumu aynı anda kesin olarak tespit edilemezdi, yani her bir kavram için minimum da olsa bir sapma, hata payı veya belirsizlik vardı. Bu belirsizlik aynı şekilde enerji ve zaman arasındaki ilişkide de geçerliydi. Thomas Young’un çift yarık deneyinde de görüleceği gibi madde ve enerji aynı anda dalga ve parçacık özelliği gösterebilir. Buna bağlı olarak, örneğin elektron parçacıksa konumunu, dalgaysa momentumunu ölçülebilir.

Heisenberg’in gözlemlerine göre atomaltı parçacıklar günlük yaşamda normal olarak görebildiğimiz nesnelerden farklı davranışlar sergilemektedir. Örneğin, bir elektronun hareketlerini incelediğimizde, elektronun konumunu kesin olarak belirlemek için ona kısa dalga boylu yani yüksek enerjili bir ışık gönderilir. (Işık gönderilerek, ışığın yansıyarak tekrar gelmesiyle konumu belirlenmeye çalışılır.) Ancak ışığın yüksek enerjili bir yapıda olması, elektrona çarptığında onu etkileyecek, momentumunu değiştirecek ve parçacığın hızı, dolayısıyla konumu yanlış hesaplanmış olacaktır. Yani özetle, atomaltı parçacıkların niceliklerinden birinin kesin olarak bilinmesi, diğer niceliği etkileyecek ve belirsizliği artıracaktır.
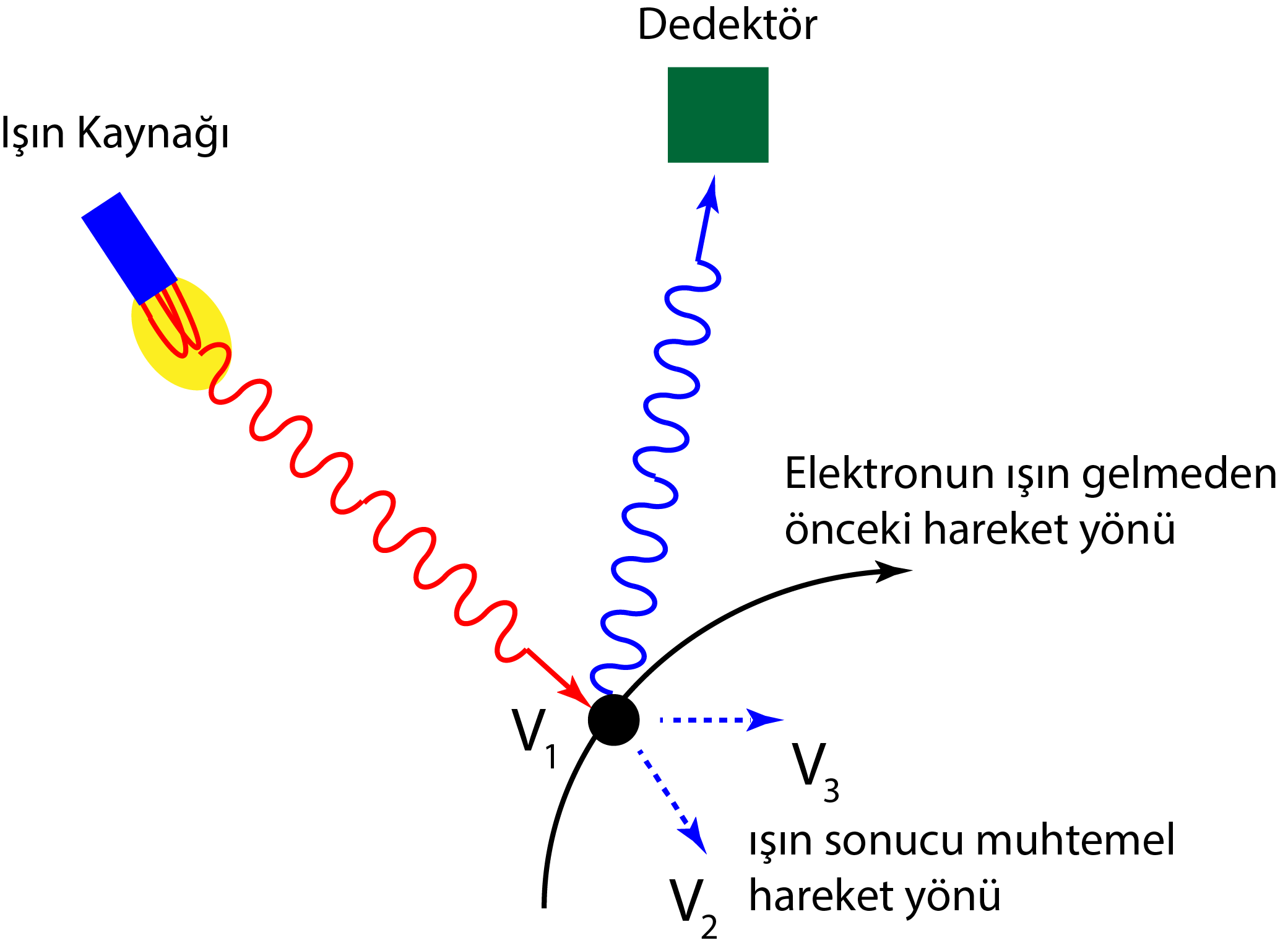
Ancak unutulmamalıdır ki belirsizlikler sadece ölçümlerden kaynaklanmamakta, aynı zamanda atomaltı parçacıkların herhangi bir anda nerede olduğunun ve nereye gittiğinin belli olmamasından yani parçacığın karakteristik özelliğinden de kaynaklanmaktadır.
Kaynak:
►Georgia State University
►Standford University
►Q Is For Quantum
YORUMLAR
Aktif etkinlik bulunmamaktadır.
-
 Dünyanın En Görkemli 10 Güneş Tarlası
Dünyanın En Görkemli 10 Güneş Tarlası
-
 Dünyanın En Büyük 10 Makinesi
Dünyanın En Büyük 10 Makinesi
-
 2020’nin En İyi 10 Kişisel Robotu
2020’nin En İyi 10 Kişisel Robotu
-
 Programlamaya Erken Yaşta Başlayan 7 Ünlü Bilgisayar Programcısı
Programlamaya Erken Yaşta Başlayan 7 Ünlü Bilgisayar Programcısı
-
 Üretimin Geleceğinde Etkili Olacak 10 Beceri
Üretimin Geleceğinde Etkili Olacak 10 Beceri
-
 Olağan Üstü Tasarıma Sahip 5 Köprü
Olağan Üstü Tasarıma Sahip 5 Köprü
-
 Dünyanın En İyi Bilim ve Teknoloji Müzeleri
Dünyanın En İyi Bilim ve Teknoloji Müzeleri
-
 En İyi 5 Tıbbi Robot
En İyi 5 Tıbbi Robot
-
 Dünyanın En Zengin 10 Mühendisi
Dünyanın En Zengin 10 Mühendisi
-
 Üretim için 6 Fabrikasyon İşlemi
Üretim için 6 Fabrikasyon İşlemi
-
 ABB Sürücü Ailesi & Yeni ACS480 Sürücüler | Webinar
ABB Sürücü Ailesi & Yeni ACS480 Sürücüler | Webinar
-
 Geleceğin Güç Altyapısı Galaxy VXL ile Tanışın | Schneider Electric
Geleceğin Güç Altyapısı Galaxy VXL ile Tanışın | Schneider Electric
-
 Senplus Pano Sistem Tanıtımı I Webinar
Senplus Pano Sistem Tanıtımı I Webinar
-
 Nasıl Dönüşür | Rüzgar Enerjisi
Nasıl Dönüşür | Rüzgar Enerjisi
-
 Nasıl Dönüşür | Hava Kalitesi İndeksi
Nasıl Dönüşür | Hava Kalitesi İndeksi
-
 Nasıl Dönüşür | Sorumlu Üretim ve Tüketim
Nasıl Dönüşür | Sorumlu Üretim ve Tüketim
-
 Webinar I Sigma Elektrik'ten Yeni ve Yenilikçi Ürün Portföyü Tanıtım Webinarı
Webinar I Sigma Elektrik'ten Yeni ve Yenilikçi Ürün Portföyü Tanıtım Webinarı
-
 Nasıl Dönüşür | Eko Etiket
Nasıl Dönüşür | Eko Etiket
-
 Nasıl Dönüşür | Uzaktan Erişim
Nasıl Dönüşür | Uzaktan Erişim
-
 Nasıl Dönüşür | Paris Anlaşması
Nasıl Dönüşür | Paris Anlaşması
ANKET














 Osman Öztürk
Osman Öztürk